 Определение, данное Международной ассоциацией по изучению боли, звучит следующим образом: «Боль — это неприятное сенсорное и эмоциональное переживание, связанное с существующими или возможными повреждениями ткани или описываемое в терминах такого повреждения».
Определение, данное Международной ассоциацией по изучению боли, звучит следующим образом: «Боль — это неприятное сенсорное и эмоциональное переживание, связанное с существующими или возможными повреждениями ткани или описываемое в терминах такого повреждения».
Различают острую (длящуюся до 10 дней) и хроническую (продолжающуюся более 3 мес) боли, механизмы развития которых принципиально различаются. Если в основе острых болей чаще лежит реальное повреждение тканей организма (травма, воспаление, инфекционный процесс), то в генезе хронической боли на первый план выходят изменения в ЦНС, вызванные длительным непрекращающимся потоком болевой импульсации от поврежденного органа. Переходной формой между этими 2 видами боли является подострая боль.
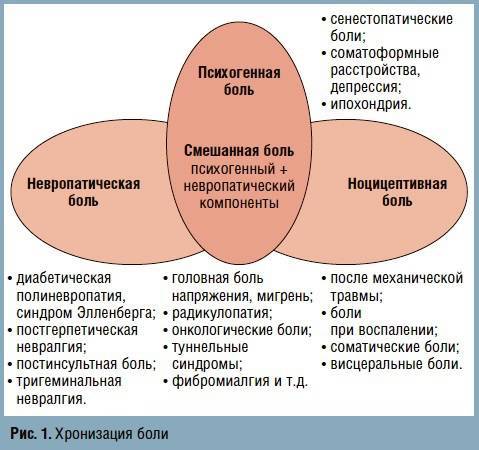
Боль, связанная с активацией ноцицепторов после тканевого повреждения, соответствующая степени тканевого повреждения и длительности действия повреждающих факторов, а затем полностью регрессирующая после заживления, называется ноцицептивной.
Невропатическая боль — это острая или хроническая боль, вызванная повреждением периферической нервной системы и (или) ЦНС при развитии дисфункции ноцицептивной и антиноцицептивной систем.
Психогенная боль — это расстройство, связанное с психологическими факторами, когда последние играют основную роль в возникновении, тяжести, усилении и сохранении боли, а соматическое заболевание (если оно есть) не имеет большого значения в возникновении, тяжести, усилении и сохранении боли. В отличие от симуляции, в возникновении психогенных болей отсутствует преднамеренность.

Характеристики невропатических болевых синдромов
- стимулзависимые боли (аллодиния, гипералгезия);
- спонтанные боли (жгучие, стреляющие, ноющие);
- гипестезия и вегетативно-трофические расстройства в зоне боли;
- эффект последействия (боль возникает или усиливается после окончания действия стимула);
- изменение временной суммации (феномен «взвинчивания» — ритмическое нанесение подпорогового болевого стимула приводит к возникновению боли).
Субъективные неприятные или необычные ощущения, отсутствующие в норме у здоровых людей, называют позитивной, или положительной симптоматикой (плюс-симптомы). Важность позитивной симптоматики определяется огромным значением боли как сигнала, побуждающего больных обратиться за медицинской помощью на ранних стадиях заболевания, когда неврологические и метаболические нарушения могут быть обратимы.
Негативной, или отрицательной симптоматикой принято называть объективно выявляемые врачом признаки неврологических нарушений (дефицитарные «минус-симптомы»).

Сенсорная позитивная симптоматика подразделяется на неболевую и болевую. К первой относятся: онемение, стягивание, зябкость, зуд, парестезии. Болевая позитивная симптоматика, или собственно невропатическая боль, представлена 2 основными компонентами: спонтанной (стимулнезависимой) болью и вызванной (стимулзависимой) гипералгезией.

Спонтанная боль подразделяется на симпатически независимую и симпатически поддерживаемую. Эти боли относят к дизестезическим, то есть возникающим вследствие нарушения нормального проведения импульса по нервным волокнам.
Симпатически независимая боль, как правило, пароксизмальная — стреляющая, дергающая, напоминающая прохождение электрического тока. Симпатически поддерживаемая боль, как правило, постоянная — жгучая, сопровождающаяся трофическими изменениями, нарушением терморегуляции и потоотделения.
Ярким примером симпатически поддерживаемых болей является каузалгия. Каузалгия — интенсивная, жгучая, непереносимая боль, сопровождающаяся аллодинией, гиперпатией, вазомоторной дисфункцией и последующими трофическими изменениями.
Однако не все спонтанные болевые феномены в структуре невропатического болевого синдрома развиваются вследствие дисфункции афферентной нервной системы. Ноющие (ломящие, мозжащие) боли связаны с развитием нейрогенного воспаления и активацией медиаторами воспаления так называемых «спящих» ноцицепторов. Такие боли часто встречаются при ноцицептивных болевых синдромах, а по отношению к невропатическому болевому синдрому являются вторичными.
Гипералгезия
Стимулзависимая боль называется гипералгезией. Гипералгезией называют интенсивную боль, возникающую при легком болевом раздражении зоны первичного повреждения (первичная гипералгезия) либо соседних и даже отдаленных зон (вторичная гипералгезия). Болевая реакция при гипералгезии не соответствует величине наносимого стимула.
В зависимости от вида вызвавшего стимула гипералгезия может быть тепловой, холодовой, механической и химической. Первичная и вторичная гипералгезии являются неоднородными. Первичная гипералгезия встречается при ноцицептивных болевых синдромах и представлена тремя типами – температурной, механической и химической, а вторичная гипералгезия двумя — механической и температурной.
Тепловая гипералгезия выявляется прикосновением к коже пробирок с теплой (36–38, 40–42°С) и горячей (выше 43°С) водой. Жгучая боль, испытываемая больным при прикосновении к пораженной зоне, не адекватна температуре пробирки и отличается от ощущения, возникающего при прикосновении в непораженной области.
Холодовая гипералгезия развивается при постепенном охлаждении пораженной области, часто описывается больными как жгучая боль.
Химическая гипералгезия обусловлена высвобождением медиаторов боли и воспаления в зоне повреждения и связана с сенситизацией первичных С-афферентов. Она выявляется при нанесении на кожу раствора слабой кислоты (лимонной, уксусной), что вызывает жгучую боль.
Механическая гипералгезия при невропатической боли – динамическая. В зависимости от способа возникновения она подразделяется на 2 подвида – гипералгезию, связанную с раздражением кисточкой («кисточковая» гипералгезия), легким прикосновением конским волосом, комочком ваты и т.п., и гипералгезию на укол иглой.
«Кисточковая» гипералгезия возникает за счет стимуляции низкопороговых механорецепторов А-β-волокон на фоне центральной сенситизации. Этот вид гипералгезии по сути является типичной формой аллодинии.
Гипералгезия на укол иглой отличается от «кисточковой» пространственно-временными характеристиками. Зона гипералгезии на укол иглой не только шире, чем «кисточковая», но и дольше сохраняется после раздражения. Она возникает за счет стимуляции А-δ- и С-волокон на фоне центральной сенситизации.
В структуре невропатического болевого синдрома нередко выявляется статическая гипералгезия, которая может быть вызвана легким тупым надавливанием и поколачиванием. Этот вид гипералгезии связан с развитием нейрогенного воспаления, запускающего процесс сенситизации «спящих» ноцицепторов С-афферентов без прямого повреждения тканей. Статическая гипералгезия чаще всего сопровождается ноющими болями и вместе с ними не относится к невропатическим болям, являясь вторичной (следствие нейрогенного воспаления).
Описанные различные типы гипералгезии связаны с определенными механизмами и отражают адаптивные изменения в периферической нервной системе и ЦНС в ответ на повреждение периферического нерва.
Формально относясь к позитивной неврологической симптоматике, гипералгезия тем не менее требует активного клинического и инструментального обследования для выявления и определения нейроанатомической локализации. Простого сбора жалоб и анамнеза, как при исследовании спонтанных болей, в данном случае недостаточно.
Аллодиния — возникновение болевого ощущения при воздействии неболевых раздражителей различной модальности (тактильных или температурных).
Гиперпатия — выраженная реакция на болевые воздействия с сохранением ощущения боли после прекращения болевой стимуляции.
Болевая анестезия — ощущение боли в зонах, лишенных болевой чувствительности.
Причинами развития невропатического болевого синдрома могут быть различные этиологические факторы, приводящие к поражению чувствительных афферентов ЦНС и периферической нервной системы.

Выделяют центральный и периферический уровни поражения нервной системы, приводящие к возникновению невропатической боли. Однако не каждое поражение периферической нервной системы или ЦНС приводит к формированию невропатических болевых синдромов, а лишь те, которые сопровождаются аномальной нейрональной пластичностью, приводящей к гипервозбудимости воспринимающих боль ноцицептивных структур и подавлению активности антиноцицептивных систем.
В настоящее время накапливается все больше свидетельств того, что в основе этих процессов лежит индивидуальная генетически обусловленная предрасположенность.
Инструментальная диагностика невропатической боли
- Электронейромиография (ЭНМГ) — «золотой стандарт» оценки степени поражения периферических нервов. Анализируются амплитуды, латенции и скорость проведения возбуждения при тестировании двигательных (М-ответ) и чувствительных (S-ответ) волокон периферических нервов.
С помощью ЭНМГ можно выявить снижение скорости распространения возбуждения (СРВ) М- и S-ответов, а также снижение скорости распространения F-волн, что свидетельствует о поражении миелиновой оболочки нерва (миелинопатии). Снижение амплитуды М- и S-ответов и повышение резидуальной латенции указывают на поражение осевого цилиндра аксона (аксонопатии).
- Для исследования тонких волокон разработаны методики количественного сенсорного тестирования (КСТ). Тест на тепловую чувствительность выявляет гипофункцию температурных С-волокон, тест на холодовую чувствительность — А-δ-волокон.
Снижение порога болевого восприятия при исследовании тепловой или холодовой болевой чувствительности указывает на тепловую гипералгезию или холодовую аллодинию. Кроме того, с помощью методики количественного сенсорного тестирования удается более точно, чем камертоном, определить порог вибрационной чувствительности; таким образом тестируется функция А-δ-волокон.
- Соматосенсорные вызванные потенциалы (ССВП) — универсальный метод диагностики афферентных сенсорных систем головного и спинного мозга.
Коротко латентные компоненты (до 100 мс) тестируют толстые миелинизированные А-δ-волокна, проводящие пути глубоких видов чувствительности в боковых канатиках спинного мозга, в том числе пучки Голя и Бурдаха, медиальную лемнисковую систему ствола мозга и соматосенсорную кору, а также дают информацию об уровне поражения нервной системы.
Длиннолатентные компоненты тестируют неспецифические системы мозга, что отражает эмоционально-аффективный компонент восприятия боли, т.е. субъективную составляющую болевого синдрома. Повышение ампитуд ССВП свидетельствует о сенситизации проводящих структур ноцицептивной системы.
Удлинение латентных периодов коротколатентных ССВП и снижение амплитуд указывают на деафферентационные процессы — поражение хорошо миелинизированных быстропроводящих волокон.
- Для избирательного тестирования медленнопроводящих волокон афферентной сенсорной системы используются лазерные и контактные тепловые ВП (CHEPS – Contact Heat-Evoked Potential Stimulator). Поздние компоненты селективно тестируют слабомиелинизированные А-δ-волокна — проводящие пути температурной чувствительности. Ультрапоздние компоненты селективно тестируют немиелинизированные С-волокна — проводящие пути болевой температурной чувствительности.
- Для морфологического подтверждения поражения периферических нервов при невропатических болевых синдромах применяется исследование плотности интраэпидермальных нервных волокон при биопсии кожи. Биопсия кожи менее травматична, чем биопсия нерва, и легче переносится больными, а информативность метода на ранних стадиях периферических невропатий — выше.
Также используется конфокальная микроскопия роговицы с подсчетом плотности тонких волокон цилиарного нерва. Субэпителиальное нервное сплетение находится под боуменовой мембраной. Его нервные волокна, перфорируя боуменову мембрану на уровне базального эпителия, формируют суббазальное нервное сплетение, волокна которого идут поверхностно, обеспечивая иннервацию базального эпителиального слоя, и заканчиваются в области поверхностных эпителиальных слоев.
В качестве критериев оценки нервных волокон используют такие показатели, как плотность, ширина, извилистость, рефлективность, ориентация, ветвление. Методика конфокальной микроскопии имеет преимущества перед биопсийными за счет неинвазивности и может использоваться для ранней диагностики полиневропатий.
Механизмы формирования невропатического болевого синдрома
Периферические:
- изменение порога возбудимости ноцицепторов или активация «спящих» ноцицепторов;
- эктопические разряды из участков аксональной дегенерации, аксональной атрофии и сегментарной демиелинизации;
- эфаптическая передача возбуждения;
- генерация патологической импульсации регенерирующими аксональными ветвлениями.
Центральные:
- нарушение окружающего, пресинаптического и постсинаптического торможения на медуллярном уровне, что приводит к спонтанным разрядам гиперактивных нейронов заднего рога;
- несбалансированный контроль спинальной интеграции из-за эксайтотоксического повреждения ингибиторных цепей;
- изменение концентрации нейротрансмиттеров или нейропептидов;
- нарушение нисходящих тормозных влияний.
Лечение невропатической боли
Показано, что этиотропное лечение, воздействующее на первопричину возникновения невропатического болевого синдрома, далеко не всегда бывает столь же эффективным, как патогенетическая терапия, направленная на патофизиологические механизмы развития боли. В соответствии с общепринятыми Европейскими рекомендациями по лечению невропатической боли, выбор симптоматического лечения обусловливается этиологической причиной возникновения болевого синдрома.

Предпринимались попытки соотнести отдельные симптомы невропатической боли с механизмами их развития и патофизиологически обоснованно стратифицировать терапию невропатических болевых синдромов. Однако на современном этапе знаний о механизмах невропатической боли реализовать такой подход клинически не удается.
Дело в том, что за развитие одного симптома могут «отвечать» несколько патофизиологических механизмов, а один и тот же патофизиологический механизм может проявляться разными клиническими симптомами, т.е. отсутствует специфичность клинико- патофизиологической связи.
Так, развитие аллодинии может быть связано с:
- повышением числа натриевых каналов на мембранах периферических аксонов;
- центральной сенситизацией нейронов заднего рога;
- регенеративным спраутингом и прорастанием терминалей А-β-волокон тактильной чувствительности во 2-ю пластину заднего рога, воспринимающую исключительно ноцицептивную информацию, и формированием новых интернейрональных связей ноцицептивных и неноцицептивных нейронов;
- патологическим усилением временной суммации болевых импульсов (феномен «взвинчивания») нейронами заднего рога;
- утратой нисходящих тормозных антиноцицептивных влияний или, напротив, с усилением нисходящей, активирующей ноцицептивные структуры задних рогов, афферентации из головного мозга.
С другой стороны, повышение числа натриевых каналов на мембранах периферических аксонов может клинически проявляться: 1) аллодинией; 2) стреляющими болями; 3) парестезиями; 4) дизестезиями; 5) динамической гипералгезией на укол иглой.
Задача терапии невропатических болевых синдромов в этой связи облегчается тем, что препарат, изолированно действующий на один патофизиологический механизм, может также помогать при боли, связанной с различными патологическими процессами. Например, антиконвульсанты, блокирующие натриевые каналы, эффективны и при аллодинии, стреляющих болях, парестезиях, дизестезиях.
Однако сложность и множественность механизмов генеза невропатической боли служит логичным обоснованием для комбинированной терапии. Поэтому назначение сопутствующей анальгетической терапии, воздействующей на другой патогенетический механизм, при недостаточной эффективности монотерапии целесообразно.
В этой связи важно понимать, как действуют на невропатическую боль основные группы препаратов, используемых для лечения хронической боли:
Антидепрессанты
Ингибиторы обратного захвата моноаминов повышают концентрацию медиаторов в синапсах антиноцицептивной системы. Таким образом, эти препараты активируют антиноцицептивную систему и подавляют проведение боли.
Из них наименее селективны трициклические антидепрессанты (ТЦА) — амитриптилин и имипрамин, зато они обладают наибольшей анальгетической способностью. В большей степени регрессу подвергаются жгучие боли и аллодиния. Важно отметить, что анальгетический эффект ТЦА проявляется уже в первые дни лечения, в то время как антидепрессивный — через несколько недель или месяцев применения. К тому же «анальгетическая» дозировка амитриптилина в несколько раз меньше «антидепрессивной» (соответственно 50—75 и 150 мг и выше).
Однако несмотря на низкие дозы, спектр побочных действий у ТЦА (обусловленные антихолинергическим действием: сухость во рту, тошнота, рвота, повышение внутриглазного давления, запор, задержка мочеиспускания; обусловленные адренергическим действием: тахикардия, аритмии, ортостатическая гипотензия, а также выраженные седативный эффект и головокружение) весьма широк, что ограничивает применение этих препаратов у лиц пожилого возраста.
Селективные ингибиторы обратного захвата серотонина (СИОЗС) — сертралин, флуоксетин, пароксетин — не вызывают столь выраженных побочных явлений, как ТЦА, но и анальгетическая активность их существенно ниже, поскольку серотонин не является основным медиатором антиноцицептивной системы. Поэтому СИОЗС в лечении невропатических болей практически не используются, за исключением эсциталопрама (Ципралекс), продемонстрировав клиническую эффективность в лечении невропатической боли даже при отсутствии у пациентов депрессии.
Антидепрессанты двойного действия — селективные ингибиторы обратного захвата серотонина и норадреналина (СИОЗСиН) — венлафаксин, дулоксетин — показали высокую анальгетическую активность при невропатических болях различной этиологии, сопоставимую с таковой ТЦА, при этом спектр побочных эффектов СИОЗСиН значительно меньше, чем у ТЦА за счет отсутствия у них антихолинергического действия.
Антиконвульсанты
Блокируя натриевые каналы на мембранах нервных волокон, противосудорожные (карбамазепин, ламотриджин) и антиаритмические (мексилетин) препараты снижают возбудимость нейронов ноцицептивных структур. Это приводит к тому, что болевая импульсация перестает генерироваться ядрами задних рогов спинного мозга и волокнами черепномозговых нервов (тройничного, языкоглоточного и др.).
В большей степени регрессу подвергаются пароксизмальные стреляющие боли, парестезии и гипералгезии. Причем более выраженный анальгетический эффект наблюдается при лечении краниальных невралгий, чем болей в нижней части тела.
Однако выраженный седативный эффект, головокружение и атаксия, возникающие вследствие неселективности подавления активности натриевых каналов (изменяется функциональная активность структур головного мозга, не вовлеченных в процессы патологической алгогенной гипервозбудимости) на фоне приема антиконвульсантов, могут настолько снижать качество жизни пациентов в первые дни приема, что они нередко вынуждены отказываться от лечения. И хотя в течение недели эти побочные явления значительно ослабевают или полностью регрессируют, терапия блокаторами натриевых каналов не всегда возможна.
Наркотические анальгетики
Наркотические анальгетики (фентанил, бупренарфип) и синтетические опиоиды (трамал, буторфанол), блокируют проведение боли на уровне задних рогов спинного мозга, воздействуя через сегментарные и нисходящие ингибиторные нейроны желатинозной субстанции, а также подавляя высвобождение альгогенного нейромедиатора — субстанции Р.
Целесообразность использования наркотических анальгетиков для лечения невропатической боли продолжает оставаться дискуссионной — анальгетическая эффективность этих препаратов существенно выше при ноцицептивной боли, а выраженные побочные эффекты и развитие лекарственной зависимости ограничивают их применение в лечении невропатических болевых синдромов.
Использование синтетических опиоидов при лечении невропатических болевых синдромов целесообразно лишь в случае интенсивной, резистентной к терапии боли, короткими курсами — до 10 дней.
Для паллиативного лечения хронических, не купируемых другими препаратами болевых синдромов, применяются трансдермальные системы с медленным высвобождением наркотических анальгетиков.
Местные анестетики
Трансдермальные системы анестезии (пластыри и гели с 2,5 и 5% содержанием лидокаина), как и антиконвульсанты, оказывают анальгетическое воздействие за счет блокады натриевых каналов, но уже на уровне периферических ноцицепторов. Препараты наносят местно на кожу в области боли и гипералгезии. Из острых побочных эффектов может наблюдаться раздражение кожи в области нанесения; чаще оно незначительное и быстро проходит.
Если площадь зоны невропатической боли не очень большая и находится в доступном для использования анестетика месте, применение лидокаина в большинстве случаев помогает купировать боль при периферических невропатических болях — таких, как диабетическая полиневропатия, опоясывающий герпес, постмастэктомические боли, комплексный регионарный болевой синдром. При центральных болях местные анестетики не эффективны.
Агонисты ваниллоидных рецепторов
Агонисты ваниллоидных рецепторов (капсаицин, нонивамид) подавляют активность периферических ноцицепторов за счет селективной стимуляции тонких немиелинизированных С-волокон периферических нервов, вызывающей высвобождение в концевых терминалях субстанции Р и других алгогенных нейротрансмиттеров. Последовательное истощение запасов субстанции Р приводит к уменьшению болевой афферентации в ЦНС и десенситизации ваниллоидных рецепторов.
Местное применение капсаицина (алкалоид жгучего перца) в виде кожных мазей и кремов оказалось эффективным в лечении поверхностных дизестетических болей, не вызывая при этом серьезных побочных эффектов. Однако некоторые пациенты прерывают терапию в самом начале из-за того, что не могут переносить усиление жжения, которое обычно возникает в 1-ю неделю лечения, а затем регрессирует.
Применение симптоматической терапии невропатической боли целесообразно сочетать с этиотропной терапией основного заболевания, приведшего к повреждению ЦНС или периферической нервной системы. Целью применения патогенетической терапии при невропатических болевых синдромах является не только уменьшение боли, но и восстановление функции пораженных нервов, что позволяет рекомендовать ее как базовое лечение.
В случае, когда больному купируют только болевой синдром, не улучшая функции нерва, исчезновение боли как сигнала опасности не побуждает пациента продолжать лечение, что в итоге приводит к усугублению сенсомоторных и вегетативно-трофических нарушений (вплоть до формирования трофических язв с последующим развитием гангрены и ампутацией конечностей).
С этой позиции разумное применение анальгетиков, воздействующих на патогенетические механизмы формирования невропатической боли, заключается в назначении их как препаратов второго ряда в качестве адъювантной терапии в дополнение к этиотропной терапии дефицитарных сенсомоторных и вегетативных нарушений.
Таким образом, для успешной терапии невропатической боли необходимы максимально ранняя дифференциальная диагностика этиологии и характера болевого синдрома и раннее начало этиотропной и симптоматической обезболивающей терапии с учетом вероятных механизмов патогенеза болевого синдрома.
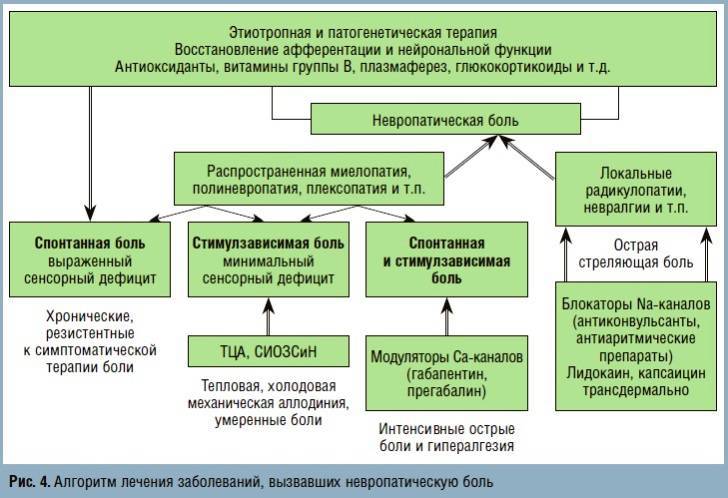
Клинические особенности заболевания, вызвавшего невропатическую боль, определяют не только этиотропную, но и симптоматическую терапию: невропатическая боль при распространенных поражениях ЦНС (миелопатии) и периферической нервной системы (полиневропатии) лучше «отзываются» на назначение антидепрессантов (если у больного преобладает аллодиния) или антиконвульсантов — блокаторов кальциевых каналов (в случае преобладания спонтанной жгучей, стреляющей боли).
У пациентов с локальным поражением (радикулопатии, мононевропатии) более эффективными оказываются блокаторы натриевых каналов. Это клиническое наблюдение отражено и в Европейских рекомендациях по симптоматической терапии невропатической боли — лечение тригеминальной, языкоглоточной и прочих невралгий рекомендуется начинать с назначения карбамазепина (в нашей стране с успехом используется Карбалепсин Ретард 200-800 мг/сут).
Назначение комбинации из 2 и более симптоматических препаратов, по-разному воздействующих на механизмы формирования невропатической боли, целесообразно при резистентных к монотерапии невропатических болевых синдромах.
А. Баринов
2012 г.