 Критическое состояние приводит к активации эндокринной, иммунной и автономной нервной системы (АНС), прежде всего ее симпатического звена. Тахикардия, артериальная гипертензия, перераспределение кровотока с его централизацией являются наиболее яркими и изученными патофизиологическими феноменами. Реакция АНС направлена на выживание организма и поддержание гомеостаза в сложившихся условиях.
Критическое состояние приводит к активации эндокринной, иммунной и автономной нервной системы (АНС), прежде всего ее симпатического звена. Тахикардия, артериальная гипертензия, перераспределение кровотока с его централизацией являются наиболее яркими и изученными патофизиологическими феноменами. Реакция АНС направлена на выживание организма и поддержание гомеостаза в сложившихся условиях.
Не только своевременная активация и адекватное по силе и продолжительности напряжение АНС, но и баланс всех звеньев этой системы являются залогом успешности и эффективности адаптации организма в условиях острой фазы критического состояния. При выживании пациента и его переходе в хроническую фазу критического состояния АНС вместе с эндокринной и иммунной системами продолжает играть ведущую роль в поддержании гомеостаза. При каждом последующем стрессорном воздействии (гнойно-воспалительные осложнения, органные дисфункции) вновь происходит активация автономной нервной, эндокринной и иммунной систем.
Рассматривая таким образом критическое состояние, становится очевидной роль АНС в выживании организма и поддержании гомеостаза. Было бы логичным предположить, что нарушения автономной регуляции висцеральных функций или дисбаланс различных звеньев АНС могут приводить к дезадаптации организма и развитию гомеостатических нарушений. В литературе такое состояние называется дисавтономией ДА.
Среди реанимационных пациентов наиболее актуальна проблема ДА при утрате регулирующих центров влияния АНС, когда происходит повреждение головного или спинного мозга, т. е. у нейрореанимационных пациентов.
Анатомия и физиология автономной нервной системы
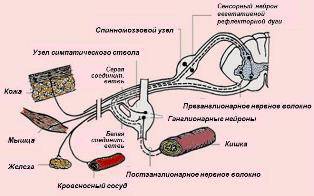
АНС, или вегетативная нервная система, регулирует тонус гладкой мускулатуры, сердечной мышцы и всех секреторных желез. Таким образом, контролируя висцеральные органы, сосуды и железы секреции, АНС обеспечивает постоянство внутренней среды организма. В отличие от соматической нервной системы ее функционирование происходит бессознательно.
Разделяется АНС на симпатическую, парасимпатическую и энтеральную, а также на центральную и периферическую.
Влияние симпатической и парасимпатической систем на висцеральные органы в определенном смысле антагонистическое. Когда симпатическая нервная система обладает стимулирующим действием на тот или иной орган, парасимпатическая угнетающим и наоборот. Иннервируя органы, симпатическая и парасимпатическая системы создают определенный базальный тонус. Это означает, что в каждый определенный момент времени орган получает как симпатическую, так и парасимпатическую стимуляцию.
Есть органы с преимущественно симпатической иннервацией, например, потовые железы, почки, и есть органы с преимущественно парасимпатической иннервацией, например, ЖКТ, матка, мочевой пузырь. Вместе с этим есть структуры, иннервирующиеся только одним звеном АНС. Так, артериолы получают исключительно симпатическую иннервацию.
С физиологической точки зрения симпатическая нервная система обеспечивает реакцию по типу «борьба или бегство», а парасимпатическая по типу «спокойствие», при котором превалируют процессы пищеварения и генитоуринарные функции.
Иннервация пищеварительного тракта осуществляется не только симпатической и парасимпатической системой, но также и ауэрбаховым и мейсснеровым сплетениями, локализованными в стенке ЖКТ. Эти сплетения содержат более 100 млн нейронов, что сопоставимо с количеством нейронов спинного мозга. Нейроны сплетений секретирует несколько десятков различных нейротрансмиттеров, регулирующих работу ЖКТ. Такая анатомия позволяет ЖКТ функционировать относительно автономно, что и явилось основанием для выделения энтеральной нервной системы в отдельную структурную единицу АНС.
Первый, преганглионарный, нейрон периферического отдела АНС находится или в спинном мозге, или в стволе головного мозга. Эта анатомическая особенность отличает АНС от соматической нервной системы, в которой структуры спинного и головного мозга лишены периферических нейронов.
Преганглионарные нейроны симпатического звена АНС лежат в латеральных рогах ThI–LII/LIII спинного мозга. Преганглионарные нейроны парасимпатического звена АНС лежат в ядрах III, VII, IX, X черепно-мозговых нервов и в копчиковых сегментах спинного мозга (SII–SIV). Преганглионарные нейроны обоих звеньев АНС имеют ацетилхолиновую нейротрансмиттерную передачу, а волокна, образованные этими нейронами, миелинизированы.
Преганглионарные симпатические нейроны короткие и заканчиваются в симпатических ганглиях, которые расположены паравертебрально в непосредственной близости от позвоночника. Выделяют 22 пары симпатических ганглиев. Преганглионарные симпатические аксоны образуют синапсы сразу же с несколькими ганглиями, что обеспечивает быстрый и генерализованный ответ симпатического звена АНС на стресс.
Преганглионарные парасимпатические волокна длинные, они оканчиваются в ганглиях, которые расположены в непосредственной близости от иннервируемого органа. Такая анатомия делает парасимпатические эффекты локальными. Три четверти всех преганглионарных парасимпатических волокон несет в себе вагус.
Постганглионарные симпатические волокна длинные, они лишены миелиновой оболочки и имеют норадреналиновую нейротрансмиссию. Парасимпатические постганглионарные волокна короткие и обладают ацетилхолиновой передачей.
Центры регуляции АНС расположены в стволе мозга, гипоталамусе и лимбической системе. Стволовые центры регуляции АНС локализованы в основном в ретикулярной формации моста и продолговатого мозга, представляя собою сеть нейронов, связанных между собой. Стволовые центры не функционируют самостоятельно, они находятся под жестким контролем вышерасположенных центров регуляции, прежде всего гипоталамуса. При утрате регулирующего влияния гипоталамуса стволовые центры неспособны взять на себя управление АНС. Совершенная координация АНС может быть достигнута только при сохранной гипоталамической регуляции.
Гипоталамус – структура массой всего 45 г, но его функциональное значение трудно переоценить. Считается, что вентромедиальные отделы гипоталамуса обеспечивают регуляцию симпатического звена АНС, а латеральные отделы гипоталамуса парасимпатического звена. Управление гипоталамическими центрами осуществляется не только опосредованно, через стволовые центры, но и напрямую, от гипоталамуса к преганглионарным нейронам.
Гипоталамус, являясь высшим центром эндокринной регуляции, поскольку управляет синтезом и секрецией всех гормонов гипофиза, а также имея обширные связи со всеми структурами лимбической системы, подкорковыми ядрами и корой больших полушарий, обеспечивает координацию и слаженную работу соматической нервной, автономной нервной, эндокринной и иммунной систем. В результате именно гипоталамус ответствен за формирование полноценного и сбалансированного ответа организма на стресс, в том числе и на развитие критического состояния. Этот ответ включает сложные поведенческие и эмоциональные реакции в сочетании с соответствующим метаболическим, эндокринным и иммунологическим сопровождением.
Конечной целью гипоталамического ответа является выживание организма при помощи поддержания постоянства внутренней среды организма вне зависимости от внешних условий. В этой связи следует еще раз подчеркнуть огромное значение АНС в выживании организма, поскольку именно посредством этой системы достигается управление функциями всех висцеральных органов, в том числе жизненно важных, управление кровотоком за счет изменения тонуса, прежде всего артериол.
Структуры лимбической системы и определенные участки коры больших полушарий, например, островок височной доли, оказывают очевидное регулирующее влияние на автономные функции. Однако, вероятнее всего, это влияние опосредовано через гипоталамус.
При анатомическом или функциональном повреждении тех или иных отделов АНС развивается состояние ее дисбаланса, или ДА.
Наиболее яркие клинические примеры дисавтономии
Перед тем как перейти к описанию клинической картины ДА у нейрореанимационных пациентов, следует привести ряд наиболее ярких примеров нарушений АНС в общеклинической практике.
- Постуральная и постпрандиальная (после принятия пищи) артериальная гипотензия развивается вследствие нарушения автономной регуляции сердечно-сосудистой системы.
- Нарушения функций тазовых органов, которые опосредованы дисрегуляцией АНС.
- При сахарном диабете все органные и трофические нарушения опосредованы, прежде всего грубыми морфологическими изменениями периферической АНС.
- Процессы старения опосредованы как нарушением регуляции АНС, так и морфологическими изменениями периферической АНС.
Клинические проявления ДА в нейрореанимации
ДА у нейрореанимационных пациентов проявляется тахикардией, артериальной гипертензией, лихорадкой, гипергидрозом, расширением зрачков, широким спектром познотонических реакций по типу децеребрации, декортикации, дистонии, мышечной ригидности или спастичности. Крайними проявлениями ДА являются нейрогенный отек легких, оглушенный миокард, или кардиомиопатия Такатцубо.
Клинические проявления ДА носят пароксизмальный характер и, как правило, начинают реализовываться в течение первых 72 ч критического состояния. Это так называемая острая ДА. При седации и обезболивании реанимационных пациентов в острой фазе критического состояния манифестация ДА в этих наблюдениях происходит позднее. При развитии септических или других осложнений в хронической фазе критического состояния могут фиксироваться такие же клинические проявления ДА, как и в острой фазе. В этом случае речь идет о продленной ДА. Те или иные проявления ДА встречаются как минимум у 20-50% нейрореанимационных пациентов.
Наиболее широко проблема ДА изучена у пострадавших с черепно-мозговой травмой и аневризматическим субарахноидальным кровоизлиянием, однако она также изучалась и у больных с внутримозговым кровоизлиянием, гипоксией, гидроцефалией и у больных с опухолями головного мозга.
Понятие ДА и терминологическая путаница
В 1929 г. Penfield при наблюдении за пациенткой с опухолью хиазмально-селлярной области описал клиническую картину пароксизмальной дисфункции АНС, назвав ее “диэнцефальными автономными судорогами”.
Затем различными авторами было предложено большое количество терминов, которые по сути описывали один и тот же симптомокомплекс: “стволовые атаки”, “центральная дисрегуляция и экстренные автономные реакции”, “гиперадреналовое состояняие”, “острый среднемозговой синдром”, “тонические децеребрационные спазмы”, “тонические децеребрационные спазмы”, “симпатоадреналовый ответ”, “синдром автономной дисфункции”, “синдром гипоталомо-среднемозговой дисрегуляции”, “гиперпирексия, сопровождаемая мышечными сокращениями”, “автономный или симпатический шторм”, “пароксизмальная автономная нестабильность с дистонией”, “пароксизмальная симпатическая гиперактивность”, “пароксизмальная гипертермическая автономная дисрегуляция”.
Термин ДА был предложен Feamside и соавт. в 1993 г.. В настоящее время большинство авторов, работающих над проблемой дисрегуляции АНС, развивающейся при острых состояниях, предпочитают использовать именно этот термин.
Этиология и патогенез ДА
Существует три основные гипотезы, которые объясняют механизмы развития ДА и ее патогенез. Первая гипотеза, исходя из которой эпилептическая активность считается причиной ДА, берет свои истоки в 1929 г., когда Penfield ввел понятие “диэнцефальные автономные судороги”. Однако последующими скрупулезными электрофизиологическими исследованиями была исключена эпилептическая природа ДА.
Следующая, наиболее распространенная и общепринятая гипотеза, предполагает, что ДА есть результат дисбаланса центральной регуляции АНС. При этом происходит чрезмерная и неконтролируемая активация симпатоадреналовой системы. Ряд авторов, подчеркивая значимость этого патогенетического звена, используют термины “симпатический или симпатоадреналовый шторм”, “симпатическая или симпатоадреналовая буря”. Именно с неконтролируемой симпатоадреналовой реакцией и угнетением парасимпатического тонуса связывают такие жизненно опасные проявления острого периода нейрореанимационных состояний, как нейрогенный отек легких, оглушенный миокард и кардиомиопатия Такатцубо.
Остается неясным, какая клиническая картина развивается при повреждении тех или иных центров АНС. Большинство авторов склоняются к мнению, что наиболее тяжелая ДА опосредована повреждением гипоталамических центров регуляции АНС, тогда как повреждение центров, расположенных в стволе, лимбической системе и коре полушарий мозга, приводит к менее выраженной ДА.
Третья, так называемая дисконнекционная гипотеза, заключается в том, что утрата регулирующего влияния со стороны центров АНС (гипоталамус, лимбическая система, стволовые структуры) приводит к гиперактивности автономных рефлексов, замыкающихся на уровне спинного мозга. Формируется своего рода автономная аллодиния, когда незначительные по интенсивности или даже физиологические стимулы вызывают симпатоадреналовую реакцию, что по сути соответствует ДА.
Диагностика ДА в нейрореанимации
ДА в нейрореанимационной практике диагностируется с помощью анализа вариабельности сердечных сокращений (ВСС) и кардиального анкаплинга (КА; расчетный показатель, свидетельствующий об отсутствии вариабельности ЧСС и соответственно об утрате регулирующего влияния АНС на проводящие пути сердца). Оба параметра основаны на математическом анализе ЭКГ пациента.
ВСС количественно измеряет активность АНС. Высокочастотный компонент ВСС ассоциирован с парасимпатическим тонусом, низкочастотный компонент с симпатическим. Соотношение высокочастотного к низкочастотному компоненту ВСС свидетельствует о балансе парасимпатического и симпатического звеньев АНС. Соответственно повышение этого соотношения говорит о превалировании парасимпатического тонуса над симпатическим, а снижение соотношения наоборот. Есть данные о том, что низкая ВСС ассоциирована с внутричерепной гипертензией и неблагоприятным исходом, в том числе летальным.
Для пострадавших с черепно-мозговой травмой характерна зависимость между тяжестью травмы и выраженностью изменения ВСС. Считается, что ВСС обладает большей прогностической силой, чем оценка пациента по шкале комы Глазго при его поступлении в стационар. Более того, ВСС, по данным литературы, более четко определяет прогноз у пациентов с черепно-мозговой травмой, чем показатели внутричерепного, церебрального перфузионного или АД.
В группе пациентов с ишемическим инсультом были получены аналогичные результаты. ВСС лучше прогнозировала летальность, чем любой другой мониторируемый параметр.
КА также является надежным прогностическим фактором для пострадавших с черепно-мозговой травмой. Этот параметр обладает прогностической значимостью при его мониторинге в течение первых 24 сут. Кроме этого, изменения КА предшествуют развитию внутричерепной гипертензии и свидетельствуют о высоком риске развития у пациента таких осложнений, как полиорганная дисфункция и надпочечниковая недостаточность.
Лечение ДА
На сегодня отсутствуют эффективные и доказанные протоколы лечения ДА. Считается, что могут быть эффективными бета-блокаторы, габапентин, бромкриптин, баклофен, холиномиметические препараты. Исходя из анатомии и физиологии АНС, а также патофизиологии ДА, гипотетически эффективными могут быть препараты, влияющие на нейротрансмиттерную передачу в структурах АНС, а также бета- и альфа-адреноблокаторы.
Бета-блокаторы, безусловно, влияют на течение критического состояния и на его исход, что доказано целым рядом исследований. Однако авторы теряются в догадках, каким же механизмом обусловлены эти благоприятные эффекты. В качестве гипотетических механизмов предполагалось влияние бета-блокаторов на гемодинамику, воспаление, метаболизм и даже коагуляцию. Однако на сегодня ни одна из этих гипотез не доказала своей состоятельности. По-прежнему приоритетной является точка зрения, что позитивные эффекты бета-блокаторов обусловлены блокадой все того же «симпатоадреналового ответа», т. е. их влиянием на ДА.
Подобная ситуация складывается и с дексмедетомидином альфа-симпатомиметическим препаратом центрального механизма действия. Использование дексмедетомидина уменьшает время проведения ИВЛ и пребывания пациента в отделении реанимации, снижает частоту развития делирия и инфекционных осложнений. Этому нет другого объяснения, кроме того, что дексмедетомидин, блокируя симпатическое звено АНС, корригирует ДА.
Таким образом, использование бета-блокаторов и дексмедетомидина оправдано всегда, когда у пациента есть основания для их назначения артериальная гипертензия и тахикардия (бета-блокаторы) и необходимость седации (дексмедетомидин). Используя такой подход в клинической практике, можно говорить о формировании новой терапевтическую парадигмы рецепторной нейровегетативной блокады.
Заключение
Автономная нервная система обеспечивает гомеостаз, принимает непосредственное участие в формировании ответа на стресс и играет ключевую роль в выживании организма в условиях критического состояния.
У нейрореанимационных пациентов происходит повреждение центров регуляции автономной нервной системы, и у подавляющего их большинства развивается состояния дисавтономии, которая в свою очередь утяжеляет их состояние и ухудшает исходы заболевания. Несмотря на очевидность значимости проблемы дисавтономии, она почти совершенно игнорируется общепринятыми терапевтическими подходами и парадигмами.
Даже такие часто применяемые и высокоэффективные направления терапии, как использование бета-блокаторов и альфамиметиков центрального механизма действия, назначаются не с целью воздействия на дисавтономию, а по каким-то иным соображениям. Вероятно, пришло время назвать вещи своими именами и создать новую терапевтическую парадигму в нейрореанимации, которая будет направлена на коррекцию дисавтономии парадигму рецепторной нейровегетативной блокады.
Попугаев К.А., Лубнин А.Ю., Забелин М.В., Самойлов А.С.
2016 г.